原子と電子の関係
別の記事「分子と原子、なにがちがうの?わかりやすく解説」にて説明した通り、
すべての物は、小さな物(粒)からできています。これが分子で、さらに
この分子より小さな小さな物(粒子)、これが原子です。
原子の構造
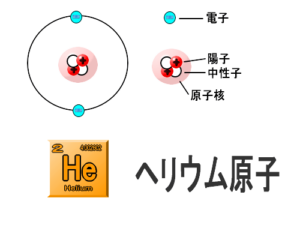
原子は中心に原子核があり、その周りを電子が回っているという構成(たとえば、太陽のまわりを衛星が回っている)と類似できます。
原子核は、原子の中心にあり、正(+)の電気を帯びた陽子と電気を帯びていない中性子からできています。
原子核のまわりにある、負(-)の電気を帯びた粒子を電子といます。
1つの原子の中では、陽子の数と電子の数は同じなので原子全体では電気的に中性になっています。
電子殻(でんしかく)
原子殻とは、中心にある原子核のまわりに、いくつかの層から構成され、
この層のことを「電子殻」(でんしかく)といいます。
原子核の内側の、K殻から外へ電子が配置され、各殻には入る数が定まっています。
- K殻 : 2個
- L殻 : 8個
- M殻 : 18個
- N殻 : 32個
電子配置
電子は、配置される定義(規則性)に基づき、配置されます。
- 電子は内側の殻から順番に配置される。
- 配置される、最外殻は8個までとされている。
例)電子20個を持つ(カルシウム)の場合、
- K殻に2個
- L殻に8個
- M殻に8個
M殻は18個収納可能ですが、最外殻は8個までと定義されているので18個ではなく8個 - N殻に2個
陽子の数が電子の数
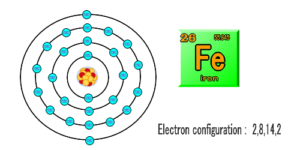
一般的な物質「鉄」を例に説明します。
金属の鉄、誰もが目にしたことがある身近なものです。
これは、物質的に考えると、元素Feのみで構成されていて、鉄の原子は、化学の周期表の通り、原子番号26の元素と定義されています。
原子番号とは、原子核の中にある陽子の個数で、つまり鉄の原子は、26個の陽子と26個の電子があるということになります。
「原子」においては,陽子の数=原子番号=電子の数
(イオンでない限り、陽子の数と電子の数は同じです。)
仮にこの陽子の数が異なればそれは鉄原子ではなくなり、陽子の数が一つ減で、原子番号25のマンガン、一つ増で原子番号27のコバルトとなります。
原子は、その原子核の中にある陽子の個数で、その個数が変わると、性質の異なる元素となります。
原子の結合と電子の関係
元素同士が結合し、もとの元素とは異なる新しい性質を持つ「分子」を形成する原子の結合には、次のような種類があります。
イオン結合
金属元素と非金属元素の間にできる結合。
電子を取り込んで安定となった陰イオンと、電子を放出して安定となった陽イオンが、静電気力で結合し、それぞれのイオンの電荷を打ち消すような割合で結合して分子を形成しています。
共有結合
非金属元素と非金属元素の間に形成される結合。
原子が持つ電子を、お互いに他の原子と共有する結合で、また、関与する電子が片方の原子からだけ供給されている場合には特に配位結合といいます。
金属結合
金属元素と金属元素の間に形成される結合。
最外殻の電子を放出して陽イオンとなり、放出された電子が自由に動き回ることによって陽イオンを結び付けているものを金属結合という。この自由に動き回れる電子を自由電子といいます。
まとめ
原子とは
原子とはすべてを構成している最小の粒。
現在確認されてる原子の種類は118種(自然界を構成しているのは92種)原子にはそれぞれ番号がつけられていて、その番号を原子番号と定義されている。
構成
原子の中心が原子核、その原子核の周りをまわるものを電子という。
原子核はプラスの電荷を、電子はマイナスの電荷を帯びている。
原子核の中身は「陽子と中性子」から構成され、陽子はプラスの電荷、中性子は無電荷 「原子核(陽子+中性子)」はプラスの電荷を帯びている。
原子核から順に(K、L、M、N)殻があり、内側から順番に、電子が配置されている。
質量と数
陽子:中性子:電子=1:1:1/11840(電子の質量は陽子、中性子と比較して極めて小さい)「原子の重さ≒陽子の重さ+中性子の重さ」
原子番号=陽子の数=電子の数
(質量数=陽子の数+中性子の数)
結合
もとの元素とは異なる新しい性質を持つ「分子」を形成する原子の結合には、イオン結合、共有結合、金属結合がある。
